Nařízení o zdravotnických prostředcích
Nařízení (EU) 2017/745

Požadavky EU MDR
Společnost Fresenius Medical Care se zavazuje, že zajistí, aby všechny naše zdravotnické prostředky splňovaly příslušné požadavky nařízení MDR v souladu s příslušnými lhůtami přechodných období.
Ohledně nařízení MDR vyvstává mnoho otázek, které se týkají následujících oblastí:
-
Vlivu nařízení na nepřetržitou dostupnost výrobků Fresenius Medical Care.
-
Podrobností o jeho platnosti pro zákazníky a uživatele našich zdravotnických prostředků.
Vzhledem k rozsahu a složitosti nového nařízení MDR jsou nové požadavky prováděny v souladu se specializovanými implementačními programy a jsou kontrolovány vrcholovým vedením v úzké spolupráci s naším oznámeným subjektem (seznam všech oznámených subjektů určených MDR najdete v části s odkazy níže*).
Relevantní informace o zavádění nařízení MDR společností Fresenius Medical Care a o jeho důsledcích pro zákazníky a uživatele našich zdravotnických prostředků najdete v následující části Otázky a odpovědi.
Otázky a odpovědi
Splňuje společnost Fresenius Medical Care požadavky nařízení MDR?
Shoda systému řízení kvality společnosti Fresenius Medical Care s příslušnými požadavky nařízení MDR byla posouzena a potvrzena v roce 2019 při externích auditech prováděných oznámeným subjektem. Od té doby jsou ohledně souladu s nařízením MDR v naší společnosti prováděny pravidelné dozorové audity.
Neméně důležitým předpokladem k získání certifikace MDR je ověřování výrobků z hlediska shody s požadavky nařízení MDR. Po úspěšném posouzení oznámeným subjektem byla do rozsahu certifikace MDR zahrnuta první kategorie výrobků. V souladu s přechodnými ustanoveními nařízení MDR se bude počet výrobků ve shodě s MDR neustále navyšovat.
Příslušný certifikát EU podle nařízení MDR vydaný oznámeným subjektem bude odpovídajícím způsobem aktualizován o příslušné kategorie výrobků.
Jaké platí pro společnost Fresenius Medical Care lhůty přechodného období z předchozí směrnice MDD na nařízení MDR?
Obecné lhůty týkající se přechodných ustanovení MDR najdete na obrázku.
U zvláštních rizikových tříd zdravotnických prostředků mohou v souladu s platnými nařízeními platit přísnější lhůty.
Lhůty nařízení MDR však podléhají přezkumu Komise EU a případným změnám, které Komise EU považuje za nezbytné. Významné příklady:
-
Komise EU z důvodu pandemie COVID-19 odložila den použitelnosti nařízení MDR o jeden rok na 26. května 2021 (nařízení (EU) 2020/561).
-
Lhůta přechodného období pro povinnou certifikaci pro konkrétní výrobky třídy I byla odložena z původního května 2020 na květen 2024. Dotčenými skupinami výrobků jsou např. softwarové aplikace zdravotnických prostředků, na které se prodloužení klasifikace vztahuje (oprava nařízení (EU) 2017/745 ze dne 25. listopadu 2019).
Kdy budou všechny dotčené výrobky Fresenius Medical Care v souladu s požadavky nového nařízení MDR?
Všechny zdravotnické prostředky budou během přechodného období stanoveného právními předpisy uvedené na trh EU v souladu s platnými požadavky EU z předchozí směrnice o zdravotnických prostředcích (MDD) na nařízení MDR.
Výrobky, které byly certifikovány podle směrnice MDD, mohou být za určitých okolností stále uváděny na trh do května 2024 i po úplném nabytí platnosti nařízení MDR, dokud platí jejich ES prohlášení o shodě.
Společnost Fresenius Medical Care proto bude během tohoto období uvádět na trh zdravotnické prostředky certifikované jak podle směrnice MDD, tak podle nařízení MDR, a do května 2024 budou výrobky Fresenius Medical Care s certifikací MDD postupně certifikovány dle MDR. V této fázi mohou být nezbytné úpravy portfolia FME.
Do května 2025 mohou být stále prodávány naskladněné výrobky certifikované dle směrnice MDD, které budou doplněny výrobky certifikovanými dle nařízení MDR.
Jaké se očekávají změny u značení výrobků certifikovaných dle nařízení MDR?
Výrobky certifikované dle nařízení MDR vyžadují jedinečný identifikátor prostředku (UDI). UDI je série číselných či alfanumerických znaků, které umožňují identifikaci konkrétních prostředků na trhu.
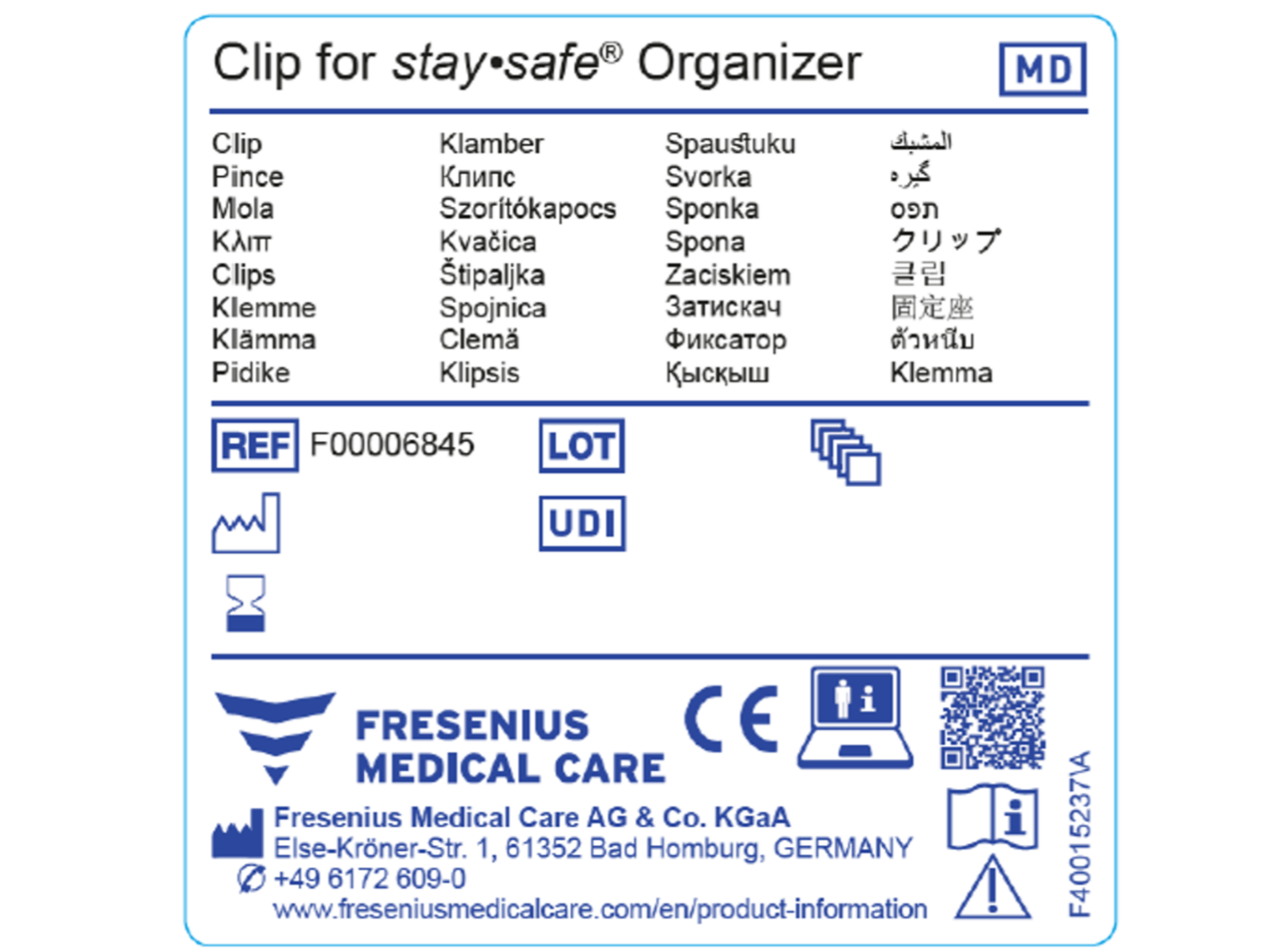
U výrobků certifikovaných dle nařízení MDR jsou nutné zvláštní symboly. Příklady jsou zobrazeny na prvním obrázku.
Kód UDI na prostředcích splňujících nařízení MDR nenahrazuje výrobní číslo. Slouží k identifikaci výrobku a k vysledovatelnosti během celého životního cyklu výrobku*.
Příklad vzorového značení v souladu s nařízením MDR najdete na druhém obrázku.
Jak velkou míru vysledovatelnosti musí zákazníci zajistit u našich zdravotnických prostředků po uplatnění požadavku na značení UDI?
Výrobky certifikované dle nařízení MDR vyžadují jedinečný identifikátor prostředku (UDI). UDI je série číselných či alfanumerických znaků, které umožňují identifikaci konkrétních prostředků na trhu.
Příslušné platné povinnosti zákazníků jsou stanoveny v informačních listech Komise EU (viz odkaz v části níže*). Ty se týkají:
-
jedinečného identifikátoru prostředku (UDI),
-
zplnomocněných zástupců, distributorů a dovozců,
-
zdravotnických pracovníků a zdravotnických zařízení.
Jak důležitá je databáze EUDAMED?
Evropská databáze zdravotnických prostředků (EUDAMED) je databáze k ukládání informací o zdravotnických prostředcích, kterou spravuje Komise EU.
Cílem databáze EUDAMED je posílit dozor nad trhem zajištěním rychlého přístupu k informacím o výrobcích, zplnomocněných zástupcích, zdravotnických prostředcích, údajích o certifikátech a vigilanci pro příslušné orgány, sdílet informace o údajích z klinických zkoušek, a také přispět k jednotnému provedení regulačních požadavků zejména ve vztahu k registračním požadavkům.
Všichni výrobci a všechny zdravotnické prostředky, které mají být uváděny na trh EU, musí být zaregistrovány v databázi EUDAMED. Výrobci (jako je společnost Fresenius Medical Care) musí zajistit, že veškeré údaje poskytnuté do databáze EUDAMED jsou správné a aktuální. Mezi tyto údaje patří údaje týkající se výrobků, údaje z různých zpráv o sledování na trhu a údaje týkající se zaregistrovaných hospodářských subjektů.
Společnost Fresenius Medical Care musí splnit požadavky týkající se registrace do databáze EUDAMED a požadavky na ohlašování v souladu se lhůtami stanovenými právními předpisy.
Stažení návodu k použití
U výrobků Fresenius Medical Care certifikovaných dle nařízení MDR bude kromě tištěné verze zajištěn návod k použití (NKP) také on-line. Návody k použití výrobků certifikovaných dle nařízení MDR najdete zde.
Základní informace o nařízení MDR
Informace a informační listy od Komise EU
Chcete-li najít následující dokumenty rychle vyhledejte:
- Nařízení (EU) 2017/745 (MDR)
- Web s obecnými informacemi o nařízení MDR od Komise EU
- Seznam oznámených subjektů určených MDR
Další odkazy viz:
- Přehled z několika informačních listů a průvodců (viz níže)
- Informační listy pro výrobce zdravotnických prostředků
- Informační listy UDI (jako PDF)
- Informační listy pro zdravotnické pracovníky a zdravotnická zařízení
- Informační listy pro příslušné úřady ze zemí mimo EU/EHP
Informace a informační listy z ostatních zdrojů
Obecné informace o nařízení MDR poskytované oborovými sdruženími a veřejnými orgány:
- https://www.niszp.cz/cs/zmena-pravnich-predpisu-tykajicich-se-zdravotnickych-prostredku
- https://www.bvmed.de/de/recht/eu-medizinprodukte-verordnung-mdr
- https://www.medtecheurope.org/new-medical-technology-regulations/
- https://www.tuev-sued.de/produktpruefung/branchen/medizinprodukte/marktzulassung-und-zertifizierung/eu-marktzugang/mdr-eu-medizinprodukteverordnung
* Informační listy Komise EU pro UDI, pro zplnomocněné zástupce / distributory / dovozce a zdravotnické pracovníky od Komise EU